Dos o más átomos se unen entre sí formando una especie química (molecular o no) mediante una fuerza denominada unión o enlace químico. Dicha unión tiene lugar siempre y cuando la sustancia formada sea más estable que los átomos que la constituyen, considerados individualmente.
Las ideas modernas para explicar las uniones químicas tienen su origen en la teoría del octeto electrónico de Lewis (1916), cuyas proporciones pueden resumirse del siguiente modo:
• Los gases inertes, por tener ocho electrones en su órbita externa, son estables es decir que no presentan actividad química. Sus átomos permanecen libres e independientes (no se combinan).
• Los metales y los no metales con menos de ocho electrones en su última órbita, tienen actividad química. Sus átomos se unen entre sí formando moléculas constituidas por dos o más átomos.
• La actividad química de los metales y los no metales se debe a la necesidad de adquirir una configuración electrónica similar a la del gas inerte más próximo, para alcanzar así estabilidad. A estos efectos ganan, ceden o comparten electrones.
Así, los átomos de sodio (Z= 11), que tienen un electrón en su órbita externa, tratan de perderlo para asemejarse al Neón (Z= 10), mientras que los átomos de Cloro (Z= 17) procuran ganar un electrón para parecerse al Argón (Z= 18). Por su parte, los átomos de Calcio (Z= 20) tienden a ceder dos electrones para adquirir la configuración electrónica del Argón (Z= 18); por el contrario, los átomos de oxigeno (Z= 8) tratan de captar dos electrones para asemejarse al Neón (Z= 10).
• En el caso de los elementos próximos al Helio, que tiene dos electrones en su órbita externa, procuran adquirir la configuración electrónica de este gas inerte.
Así, el hidrógeno, con un solo electrón, procura ganar otro para asemejarse al Helio; por el contrario, el Litio (Z= 3) que también tiene un electrón externo, trata de cederlo para lograr la misma estructura electrónica.
NOTACIÓN DE LEWIS
Para simplificar la representación de los átomos y teniendo en cuenta que las características químicas de ellos dependen generalmente de los electrones de la última órbita, Lewis propuso una forma sencilla de representación:
“Cada átomo se representa con su símbolo y a su alrededor puntos en igual cantidad a los electrones que tiene en su órbita externa”.
A modo de ejemplo:

También se aconseja que los electrones se representen de a pares cuando corresponden a orbitales completos y solos en el caso de orbitales incompletos.
TIPOS DE UNIONES QUÍMICAS
Los átomos, al unirse entre sí para formar moléculas, lo hacen de diferentes formas, conocidas como tipos de uniones químicas.
Los principales tipos son:
• Unión iónica o electrovalente.
• Unión covalente.
• Unión metálica.
UNIÓN IÓNICA O ELECTROVALENTE
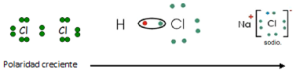
Este tipo de unión es característico de los compuestos formados por un metal y un no metal. Así, en el caso del cloruro de sodio (sal de esa) ocurre lo siguiente:
a) El átomo de sodio (Z= 11) tiene bajo potencial de ionización, trata de perder el electrón de su órbita externa para parecerse al gas inerte más próximo que es el Neón (X=10) en cuyo caso se transforma en un catión de Sodio con una carga positiva (monovalente).
b) Átomo de cloro (Z= 17). Como el gas más próximo al Cloro es el Argón (Z=18), este átomo, de elevada afinidad electrónica, trata de ganar un electrón, convirtiéndose en un anión cloruro con una carga negativa (monovalente).
c) Cuando se produce el contacto entre un átomo de Sodio y otro de Cloro, ocurre la transferencia del electrón del primero al segundo, convirtiéndose en catión Sodio y anión cloruro, respectivamente. Como estos iones tienen cargas eléctricas de signo contrario, se atraen, y queda formado el cloruro de sodio:
Otro ejemplo:
En el caso del óxido de Calcio, que es conocido en el comercio bajo la denominación de “cal viva”, sucede lo siguiente:
Los átomos de calcio ceden los dos electrones externos para adquirir la estructura electrónica del Argón, mientras que los átomos de oxígeno los ganan para asemejarse al Neón. En consecuencia se forman cationes de calcio y aniones oxígeno, lo cual puede representarse así:
En la formación de estos compuestos es necesario que haya igualdad entre los electrones ganados y los perdidos. En los casos anteriores esto se logra con un átomo de cada elemento, pero en otras ocasiones es algo más complicado.
Así, en el cloruro de Calcio, cada átomo de Calcio pierde dos electrones formando el catión Ca2+ y son necesarios dos átomos de cloro para que cada uno de ellos gane uno de dichos electrones, originando dos aniones Cl-1.
En la reacción del aluminio con el oxígeno (óxido de Aluminio), cada átomo de aluminio cede tres electrones mientras que los de oxígeno aceptan dos; por lo tanto, deben unirse dos átomos de aluminio con tres de oxígeno, según se observa en la siguiente representación:
En síntesis:
Este tipo de unión se produce entre elementos con bajo potencial de ionización (metales) y elementos con elevada afinidad electrónica (no metales).
«La unión iónica es aquella en que hay trasferencia de electrones de un metal a un no metal, formándose cationes y aniones, respectivamente, que se mantienen unidos entre sí por fuerzas electrostáticas«.
Propiedades de los compuestos iónicos
Las sustancias que se forman por unión iónica se caracterizan por presentar las siguientes propiedades comunes:
• Tienen puntos de fusión y ebullición altos (más de 700 ºC), por lo cual a la temperatura ambiente se encuentran en estado sólido.
• Son solubles en agua.
• Fundidas o en solución conducen la corriente eléctrica continua, descomponiéndose (se comportan como electrólitos).
• Presentan estructura cristalina iónica.
• Son duras y frágiles.
UNIÓN COVALENTE
Este tipo de unión se observa en las moléculas, constituidas por átomos de no metales, como es el caso de las moléculas biatómicas de los gases simples (Cloro, Hidrógeno, Oxígeno, Nitrógeno, Flúor).
En la molécula de Cloro (Cl2), los dos átomos que la forman tienen siete electrones externos y necesitan uno más para completar el octeto. Es lógico suponer que uno de los átomos de Cloro no puede quitarle un electrón al otro porque son iguales, entonces comparten un par de electrones (uno de cada átomo):
Ninguno de los dos átomos adquiere la posesión total de ambos electrones, por lo cual a veces un átomo y otras el otro, tiene completa su última órbita, asemejándose al gas inerte más próximo que es el Argón.
Esta forma de unión interatómica se denomina Unión covalente.
De modo similar se origina la molécula de hidrógeno (H2). Cuando dos átomos de Hidrógeno chocan, cada uno intenta arrancarle un electrón al otro, pero como no puede lograrlo, quedan compartiendo los dos electrones para parecerse al Helio.
En el caso del Oxígeno (O2), como los dos átomos tienen seis electrones externos deben compartir dos pares de electrones para adquirir la estructura electrónica del Neón.
Los átomos de Nitrógeno, al tener cinco electrones es su última órbita, deben compartir tres pares electrónicos para formar una molécula de Nitrógeno (N2)
la unión covalente no solo se observa en las moléculas simples, sino también en muchas otras que forman las sustancias compuestas, con el dióxido de carbono, el agua, el metano, el cloruro de Hidrógeno, etcétera.
Dióxido de Carbono
Monóxido de Azufre

Agua
Cloruro de Hidrógeno

En todos los casos, los electrones siempre se comparten de a pares, pudiendo los átomos compartir uno dos o tres pares de electrones, dando uniones covalentes simples, dobles o triples, respectivamente.
En suma:
«En la unión covalente los átomos comparten uno o más pares de electrones para completar el octeto externo. Esta unión se produce entre los átomos de no metales».
Polaridad de la unión covalente
En el caso de los gases simples (Cloro, hidrógeno, oxígeno, etc.), como los átomos que forman las moléculas son iguales, sus núcleos atraen con igual intensidad al par de electrones que comparten y, en consecuencia, la distribución de las cargas eléctricas es uniforme. Las moléculas no presentan zonas o polos con cargas eléctricas y por ello se llaman moléculas no polares.
En cambio cuando los átomos que constituyen la molécula son diferentes, pueden presentarse casos como el siguiente:
En el cloruro de Hidrógeno (HCl), el cloro ejerce mayor atracción sobre el par de electrones compartidos que el hidrógeno. Esto determina que dicho par permanezca más tiempo en las proximidades del Cloro que en las del Hidrógeno, lo cual puede representarse así:

En consecuencia la región correspondiente al Cloro adquiere una cierta carga negativa y por el contrario, la zona del Hidrógeno tiene una carga igual pero de signo positivo.
Por lo tanto, la molécula tiene una distribución desigual de las cagas eléctricas, presentando un polo negativo y otro positivo, es una molécula polar.
En consecuencia, según que el par de electrones sea compartido por ambos átomos de modo igual o desigual, la unión covalente se puede clasificar en: polar o no polar.
Toda unión entre átomos diferentes es más o menos polar. La polaridad de las moléculas formadas depende de los elementos que las constituyen. Así, es mayor en la unión del Cloro con el Hidrógeno que en el caso del Bromo con el Hidrógeno.
Electronegatividad
Con relación a la mayor o menor capacidad que presentan los átomos para atraer a los electrones que comparten en una unión covalente, se ha introducido el concepto de electronegatividad, que puede definirse así:
«Electronegatividad es la capacidad que posee un átomo para atraer al par de electrones que comparte en una molécula covalente».
Los átomos que atraen con mayor intensidad al par de electrones compartidos son más electronegativos y corresponden a los no metales, como F, Cl O, S, etcétera.
El químico norteamericano Linus Pauling confeccionó una tabla de electronegatividades de los elementos. El elemento más electronegativo es el Flúor, con un valor de 4.0 y el menos electronegativo es el Francio, con o.7.
Los gases inertes no se incluyen, pues generalmente no forman uniones químicas.
Entre los no metales, el Hidrógeno tiene el valor más bajo con 2.1. Los metales presentan una electronegatividad inferior a la del Hidrógeno.
A continuación se transcribe la Tabla de Electronegatividades de los elementos:

Los valores de electronegatividad permiten predecir el tipo de unión química que se establece entre dos elementos. Cuando la diferencia de electronegatividad es grande, cabe esperar que la unión sea iónica: así el Sodio (0.9) y el Cloro (3.0) forman un compuesto iónico. Por el contrario, si la diferencia de electronegatividad es pequeña, el compuesto que se forma es covalente.
Se considera como una de las condiciones necesarias para que un compuesto sea iónico, que la diferencia de electronegatividad sea mayor de 1.7. En cambio, si la diferencia de electronegatividad es menor, el compuesto será covalente.
La electronegatividad también es útil para predecir la polaridad de las uniones covalentes. Cuando la diferencia de electronegatividad es menor de 0.4 la unión es covalente no polar. Por el contrario, si dicha diferencia es mayor que 0.4 la unión será covalente polar.
El criterio antes expuesto no es absoluto y solo sirve de orientación, pues existen muchos otros factores que determinan el tipo de unión química.
Transición de la unión covalente a la iónica
No existe en límite definido entre la unión covalente y la unión iónica. Si lo átomos que se unen tienen la misma electronegatividad, presentan la misma capacidad para atraer al par de electrones que comparten y, en consecuencia, la unión que establecen es covalente no polar (moléculas no polares).
A medida que la diferencia de electronegatividad entre los átomos se incrementa, también va aumentando la polaridad de la unión (unión covalente polar). Entonces la molécula es polar y parcialmente iónica.
Cuando la diferencia de electronegatividad es aún mayor, el par de electrones deja de estar compartido para ser captado exclusivamente por el elemento de mayor electronegatividad, formándose un anión y un catión. Estos se atraen por fuerzas electrostáticas y la unión es iónica.
A modo de ejemplo:
Unión covalente coordinada o dativa
En algunos compuestos se observa otra forma de unión covalente, en la cual el par de electrones que comparten es aportado por uno dolo de los átomos.
Para comprender este tipo de unión, procederemos a analizar el caso del azufre, que tiene la propiedad de formar tres óxidos: monóxido de Azufre (SO), dióxido de Azufre (SO2) y trióxido de Azufre (SO3).
En el monóxido de Azufre (SO), como el Azufre y el Oxígeno tienen seis electrones en su órbita externa, proceden a compartir dos pares de electrones para completar su octeto externo, formando una unión covalente doble.
Unión covalente doble
Como al Azufre le quedan dos pares de electrones sin compartir, puede utilizar uno de ellos para unirse a otro oxígeno, formándose el dióxido de Azufre:
En este compuesto se observan una unión covalente doble representada con guión y otra unión covalente coordinada, representada con una flecha.
Al Azufre aún le queda un par de electrones libres que puede compartir con otro átomo de oxígeno, formando el trióxido de azufre (SO3):

En este caso hay una unión covalente doble y dos uniones covalentes coordinadas.
Todas las uniones en que se comparten electrones reciben el nombre de covalentes, pero cuando el par de electrones compartidos es aportado por uno solo de los átomos, se las distingue con la denominación de unión covalente coordinada o dativa.
El átomo que aporta el par electrónico que se comparte se llama dador y el átomo que acepta compartirlo se denomina aceptor.
Propiedades de los compuestos covalentes
Las sustancias que presentan unión covalente manifiestan las siguientes propiedades:
• Los puntos de fusión y ebullición son bajos (menos de 300 ºC) porque las fuerzas que mantienen unidas entre sí a las moléculas generalmente son débiles.
• Solubles en solventes orgánicos no polares, como éter, cloroformo, sulfuro de carbono, nafta, etcétera.
• No conducen la corriente eléctrica pues carecen de iones.
• Presentan estructura cristalina atómica o molecular.
• Forman moléculas que sólo se mantienen unidas por fuerzas débiles, denominadas fuerzas de Van der Waals.
UNIÓN METÁLICA
Esta forma de unión se encuentra entre los átomos de los metales.
Ya se ha señalado que los átomos de los metales tienen menos de cuatro electrones en su última órbita y pueden perderlos con relativa facilidad, en cuyo caso se convierten en iones positivos (cationes).
Por este motivo, se considera que una porción de metal está constituida por un conjunto de cationes, entre los cuales se mueven con bastante libertad los electrones, formando una “nube” o “mar de electrones”.

Propiedades de los metales
Los metales se caracterizan por presentar propiedades tales como:
• Brillo característico. Este brillo se debe a la movilidad de los electrones, la luz que incide sobre un metal es absorbida por los electrones libres que se mueven rápidamente emitiendo energía radiante que se aprecia como brillo.
• Conductividad eléctrica. La corriente eléctrica es el desplazamiento de electrones, los cuales al llegar al metal repelen a los electrones externos de dicho metal por tener carga de igual signo y así permiten el paso de la electricidad.
• Maleabilidad y ductilidad. La facilidad con que pueden deslizarse unas capas sobre otras hace que sea muy fácil producir láminas delgadas o hilos metálicos.
ATRACCIONES INTERMOLECULARES
Las consideraciones anteriores sobre uniones químicas muestran que la estructura de los átomos determina el tipo de unión que se establece para formar las moléculas, lo cual origina distintas estructuras moleculares.
Como consecuencia de la estructura que presentan las moléculas se producen entre ellas diferentes fuerzas de atracción. Esta fuerzas son de distinta intensidad y mantienen más o menos unidas entres sí a las moléculas, determinando las propiedades que caracterizan a las distintas sustancias.
Las fuerzas de atracción intermoleculares se denominan fuerzas de Van der Waals.
Entre las fuerzas de Van der Waals se pueden mencionar: las fuerzas de London, dipolo-dipolo inducido, dipolo-dipolo y unión puente de hidrógeno.
Fuerzas de London
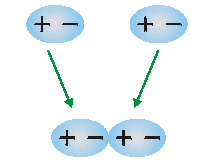
En las moléculas no polares puede producirse transitoriamente un desplazamiento relativo de los electrones originando un polo positivo y otro negativo (dipolo transitorio) que determinan una atracción entre dichas moléculas. (El polo positivo de una molécula atrae al negativo de otra y viceversa).

Estas fuerzas de atracción son muy débiles y se denominan fuerzas de London. Su intensidad es proporcional al grado de polarización momentáneo que se produce en las moléculas.
En los gases inertes (He, Ne, Ar, etc.) las fuerzas de London se manifiestan a muy bajas temperaturas, ocasionando la licuación de dichos gases.
Fuerzas dipolo-dipolo inducido
En ciertas ocasiones, una molécula polar (dipolo), al estar próxima a otra no polar, induce en ésta un dipolo transitorio, produciendo una fuerza de atracción intermolecular llamada dipolo-dipolo inducido.

Así el agua, cuya molécula es un dipolo, produce una pequeña polarización en la molécula no polar del oxigeno, la cual se transforma en un dipolo inducido.
Esto hace que el oxígeno y el dióxido de carbono presenten cierta solubilidad en solventes polares como el agua.
Fuerzas dipolo-dipolo
Cuando dos moléculas polares (dipolos) se aproximan, se produce una atracción entre el polo positivo de una de ellas y el negativo de la otra. Esta fuerza de atracción entre dos dipolos es tanto más intensa cuanto mayor es la polarización de dichas moléculas polares.
Estas fuerzas de atracción, llamadas dipolo-dipolo, se observan en las moléculas formadas por unión covalente polar, como el dióxido de Azufre (SO2), sulfuro de Hidrógeno (H2S), etcétera.
Entre las fuerzas dipolo-dipolo tiene particular importancia la unión puente de Hidrógeno.
Unión puente de Hidrógeno
En algunas sustancias que contienen hidrógeno, como el agua (H2O), fluoruro de Hidrógeno (HF) y amoníaco (NH3) se observa una forma de unión entre sus moléculas, denominada unión puente de Hidrógeno.
En el caso de HF las moléculas son covalentes polares, como consecuencia de la diferencia de electronegatividad que existe entre el Hidrógeno y el Flúor:
Esta polarización provoca la atracción de la zona positiva de una molécula con la zona negativa de otra:
De este modo el Hidrógeno forma un puente entre dos átomos de Flúor y de allí proviene el nombre de unión puente de Hidrógeno. Así se forman cadenas moleculares de fluoruro de Hidrógeno donde los átomos de Hidrógeno vinculan entre sí a los átomos de flúor.
Las moléculas de agua también son dipolos a causa de la diferencia de electronegatividad entre el Oxigeno y el Hidrogeno y pueden formar uniones puente de Hidrógeno:

Como consecuencia de este tipo de unión, las moléculas de agua se agrupan formando conglomerados de masa relativamente alta:

El agua, al solidificarse, aumenta el número de sus uniones puente de Hidrógeno, formando hexámeros en las tres dimensiones del espacio. Entonces, el hielo tiene una estructura abierta y porosa, por lo cual la densidad del agua solida es menor que la del agua líquida. Esta propiedad es atípica, pues generalmente las sustancias tienen mayor densidad en estado sólido que en el líquido.
La unión puente de hidrogeno, también explica que los puntos de fusión y de ebullición sean más altos que lo que puede predecirse de acuerdo con la masa molecular del agua.
Fuente:
Wikipedia.
FÍSICANET.
Química. Aula Taller. José María Mautino. Editorial Stella.














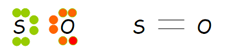



Felicito tu pagina, me sirvió para mi tarea de físico-química y la información que tiene es genial!. Saludos.
2ºB.
gracias por ayudarme
Gracias me sirvió mucho! EXCELENTE!
Muy buena página, es muy útil y te animo a seguir escribiendo artículos así de buenos. Gracias
Genial, muy entedible.
Gracias, me sirvio mucho y aclaro varias dudas.
Muy bueno la verdad. La primera vez que lo entiendo después de tanto que lo estudié. Mil gracias.
Excelente página !!! muchas gracias
Excelente!!
Buenisimo!