Desde el siglo V a. de C. la humanidad ha escuchado hablar de átomos, como las partículas fundamentales de la materia.
Sin embargo, debido a que los átomos son tan pequeños, no es posible verlos a simple vista, por esta razón, se han propuesto varios modelos y teorías acerca de cómo son estas partículas fundamentales.
Un modelo atómico es una representación estructural de un átomo, que trata de explicar su comportamiento y propiedades.
La teoría atómica actual se basa en cuatro hechos experimentales: la electrólisis, la descarga en gases, la radiactividad y la espectroscopia química.
La investigación del proceso de electrólisis posibilitó inferir que la materia es de naturaleza eléctrica.
Los experimentos sobre descargas eléctricas en gases a baja presión permitieron comprobar que los átomos están formados por partículas materiales negativas (electrones) y positivas (protones). A partir de estos descubrimientos Thomson propuso el primer modelo atómico.
El descubrimiento de la radiactividad posibilitó la realización de experiencias que llevaron a Rutherford, a sostener que el átomo tiene un núcleo central con carga positiva.
El análisis de los espectros atómicos producidos por el hidrogeno permitió a Bohr proponer una hipótesis, basada en la teoría cuántica de Planck, que supone que los electrones están ubicados en órbitas circulares, denominadas niveles de energía. Como resultado de estas investigaciones surgió el modelo atómico Rutherford–Bohr. Asimismo, fue posible definir dos números importantes (número atómico y número másico), establecer el concepto de isótopos y profundizar la noción de iones.
En razón de que la hipótesis de Bohr no explicaba nuevos hechos experimentales, Sommerfeld sugirió que los electrones también describen órbitas elípticas.
El estudio del espectro de diferentes elementos llevó a concebir la existencia de subniveles energéticos.
Al sostener De Broglie que las partículas muy pequeñas como los electrones presentan a dualidad onda-partícula, Heisenberg enunció el principio de incertidumbre. A partir de este principio y aplicando el cálculo de probabilidades se llegó a la noción de orbital atómico en reemplazo del concepto de órbita.
Esta concepción del átomo surge al resolver la ecuación de onda de Schrödinger que permitió introducir los números cuánticos
Demócrito (siglo V a. C.)
Los filósofos de la Antigua Grecia, se cuestionaban bastante sobre qué ocurriría si dividieran un trozo de materia muchas veces. El problema es que estos filósofos no utilizaban ni la medición ni la experimentación para llegar a conclusiones, por tanto, no seguían las fases del método científico.
De esta forma, se establecieron dos teorías: atomista y continuista, que se basaban en la existencia de partes indivisibles o en que siempre se podía seguir dividiendo.

En el siglo V. a.C., Leucipo pensaba que sólo había un tipo de materia. Sostenía, además, que si dividíamos la materia en partes cada vez más pequeñas, acabaríamos encontrando una porción que no se podría seguir dividiendo, un discípulo suyo, Demócrito, bautizó a estas partes indivisibles de materia con el nombre de átomos, término que en griego significa “que no se puede dividir”.
Demócrito
Los atomistas pensaban que:
– Todo está hecho de átomos, si dividimos una sustancia muchas veces, llegaremos a ellos.
– Las propiedades de la materia varían según como se agrupen los átomos.
– Los átomos no pueden verse porque son muy pequeños.

Aristóteles
Aristóteles rechazó la teoría atomista y estableció que la materia estaba formada por cuatro elementos: tierra, agua, aire y fuego, esta teoría se llamó continuista. Gracias al prestigio que tenía, se mantuvo vigente en el pensamiento de la humanidad durante más de 2000 años.

Los continuistas pensaban que:
– Los átomos no existen. No hay límite para dividir la materia.
– Si las partículas, llamadas átomos, no pueden verse, entonces es que no existen
– Todas las sustancias están formadas por las combinaciones de los cuatro elementos básicos: agua, aire, tierra y fuego.
Teoría átomica de Dalton
En 1808 el investigador inglés John Dalton publicó su teoría atómica, que retomaba las antiguas ideas de Leucipo y de Demócrito pero basándose en una serie de experiencias científicas de laboratorio.
La teoría atómica de Dalton se basa en los siguientes enunciados:
– La materia está formada por átomos, pequeñas esferas rígidas indivisibles e indestructibles.
– Los átomos de un mismo elemento químico son todos iguales entre sí y diferentes a los átomos de los demás elementos.


– Los compuestos se forman al unirse los átomos de dos o más elementos en proporciones constantes y sencillas.


4.- En las reacciones químicas los átomos se intercambian; pero, ninguno de ellos desaparece ni se transforma.
En esta reacción química los átomos de hidrógeno y los átomos de Oxígeno son iguales al principio y al final. Solo cambia la forma en que se unen entre sí, el Hidrógeno y el Oxigeno serían los reactivos y el Agua seria el producto que se obtiene.
La teoría de Dalton se consideraba “la teoría atómica moderna”, con esta teoría se explica: la ley de conservación de la masa, la ley de la composición constante y la ley de las proporciones múltiples.
Los símbolos de Dalton
Para Dalton, cada elemento está formado una clase de átomos, distinto en sus propiedades a los átomos de los demás elementos y, justamente, es esta distinción lo que separa un elemento de otro y los hace diferentes.
Así, asignó a cada elemento conocido un símbolo distinto, su símbolo químico que con posterioridad ha ido cambiando hasta llegar a los modernos símbolos químicos actuales.

Limitaciones de la teoría atómica de Dalton:
El modelo atómico de Dalton fracaso al comprobar que el átomo era divisible y tenía naturaleza eléctrica.
Estas conclusiones se obtuvieron al estudiar las descargas eléctricas sobe los gases en los tubos de vacío, que dieron lugar al descubrimiento de los rayos catódicos y rayos canales y en ellos el electrón y el protón.
Naturaleza eléctrica de la materia
Fenómenos eléctricos
Algunos fenómenos de electrización pusieron de manifiesto la naturaleza eléctrica de la materia.
Para explicar estos fenómenos, los científicos idearon un modelo según el cual los fenómenos eléctricos son debidos a una propiedad de la materia llamada carga eléctrica.
Las propiedades de los cuerpos eléctricos se deben a la existencia de dos tipos de cargas: positiva y negativa.
Dos cuerpos que hayan adquirido una carga del mismo tipo se repelen, mientras que si poseen carga de distinto tipo se atraen.

En general, la materia es eléctricamente neutra, es decir, tiene la misma cantidad de cada tipo de carga. Si adquiere carga, tanto positiva como negativa, es porque tiene más cantidad de un tipo que de otro.
La electrólisis
A principios del siglo XIX se observó que ciertas sustancias en estado líquido sufrían transformaciones químicas al ser atravesadas por la corriente eléctrica continua.
En 1833 Faraday realizó cuidadosos estudios cuantitativos sobre este fenómeno, que recibió la denominación de electrólisis.
¿Qué significa el término ELECTRÓLISIS y cómo se realiza?
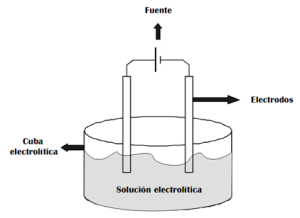
La electrólisis es la descomposición de la materia por acción de la corriente eléctrica. El experimento consiste en conectar dos barras metálicas a un generador de energía eléctrica, como se muestra a continuación:
Supongamos el caso de la electrólisis del agua: por acción de la corriente eléctrica el agua se disociará en iones hidrógeno (H+) e iones (O-2) y cada uno de estos iones se dirigirá al electrodo de signo contrario:
“Cargas de mismo nombre se rechazan y cargas de distinto nombre se atraen”
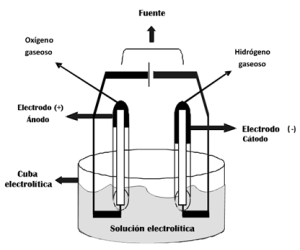
El ion (H+) se dirigirá al cátodo (que es negativo) y al llegar a él se neutralizarán las cargas opuestas que toman del mismo formándose hidrógeno gaseoso. El ion (O-2) se dirigirá al ánodo (que es positivo) y sucederá lo mismo que en el cátodo formándose oxígeno gaseoso. Por esta causa, los iones positivos se denominan cationes y los negativos aniones.
Algunas sustancias aparecen en forma gaseosa, como el hidrógeno y el oxígeno, ascienden como burbujas junto al electrodo abandonando el líquido.
Otras sustancias recubren el electrodo con una fase sólida (depósito electrolítico) como en el caso de la deposición de metales.
Faraday determinó, a partir de sus experiencias electrolíticas, que:
“En esta época aún no se sabía cómo era el átomo ni cómo intervenían en él las cargas eléctricas pero Faraday sugirió la existencia de una cantidad elemental de carga que no podía ser subdividida. Los físicos y los químicos se preguntaron entonces, si esa unidad de carga era positiva o negativa”.
Este fenómeno de descomposición del agua por la acción de la corriente eléctrica continua también sucede en otras sales, en las bases y en los ácidos.
A todas las sustancias que se descomponen por el paso de la corriente eléctrica continua se las denomina electrólitos.
En consecuencia se puede afirmar que:
«La electrólisis es el proceso de descomposición química de una sustancia por el pasaje de corriente eléctrica continua».
El hecho de que la corriente eléctrica pueda producir transformaciones químicas, indica una relación entre la electricidad y la materia. Como la materia está constituida por átomos, éstos deben tener una estructura parcialmente eléctrica para que la electrólisis puede efectuarse.
«La electrólisis de las sustancias permitió inferir que la materia es de naturaleza eléctrica».
El átomo está constituido por partículas materiales
El átomo es divisible
En 1808, el investigador inglés John Dalton, en base a hechos experimentales, retomo la idea que varios siglos antes había propuesto el filósofo griego Demócrito y sostuvo que la materia está constituida por átomos y que estos no podían dividirse, o crearse o destruirse.
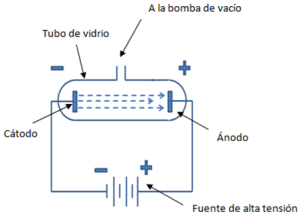
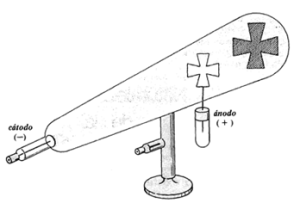
Aunque en la segunda mitad del siglo XIX ya existía una sospecha generalizada de que los átomos eran divisibles, este hecho solo pudo ser confirmado por las experiencias efectuadas en 1897 por Joseph Thomson (1856-1940) con tubos de descarga. Estos, también llamados tubos de Crookes o de rayos catódicos, están constituidos por un cilindro de vidrio, cerrado, en cuyo interior se encuentran dos placas metálicas, llamadas electrodos, ubicadas en los extremos. Esos electrodos se conectan con los polos positivo y negativo de una fuente de alta tensión (el electrodo positivo se llama ánodo y el negativo cátodo). El aire del interior del tubo se extrae por medio de una bomba de vacío.
Descarga en gases
En las condiciones habituales de presión puede considerarse que los gases que componen el aire (nitrógeno, oxígeno, etc.) no conducen la corriente eléctrica. Se ha comprobado que se requieren unos 30.000 V para que salte una chispa eléctrica entre dos conductores ubicados en el aire a 1 cm de distancia entre sí.
En el caso de los rayos que se producen durante las tormentas, existe una diferencia de potencial de varios cientos de miles de voltios entre la tierra y las nubes, lo cual es muy difícil de obtener en el laboratorio.
A partir de mediados del siglo XIX, la tecnología del vidrio y del vacío hizo posible el estudio de los fenómenos de descarga eléctrica en gases a baja presión. Varios físicos (Geissler, Plücker, Hittorf, Goldstein, Stoney, etc.) se dedicaron al estudio de estos fenómenos y observaron que al disminuir la presión de un gas a valores de 0,01 mm de mercurio, hay conducción eléctrica con producción de radiaciones.
Esquema de un tubo de descarga
Los tubos de descarga constan de un tubo de vidrio, en cuyo interior se encuentran dos placas metálicas llamadas electrodos, soldadas en los extremos de dicho tubo.
Los electrodos se conectan con los polos positivos y negativos, respectivamente, de una fuente de alta tensión (el electrodo positivo se llama ánodo y el negativo cátodo).
Rayos catódicos: los electrones
Si el tubo de descarga está lleno de aire a presión normal (750 mm de mercurio) y se aplica a los electrodos una tensión de hasta 10.000 V, no se observa ningún cambio. Por el contrario, si comienza a hacerse el vacío en el tubo, extrayendo aire con una bomba de vacío, empieza a circular la electricidad y el escaso aire que queda en el tubo se pone luminoso. Cuando la presión interior del tubo se reduce al orden de 0.01 mm de mercurio, cerca del ánodo se observa una luminosidad azul verdosa. Los científicos creyeron que esa luminosidad era causada por rayos provenientes del cátodo y los llamaron rayos catódicos.
Características de los rayos catódicos: el estudio de los rayos catódicos permitió observar las siguientes características:
- Si bien son invisibles en sí mismos, producen sombras que tienen la forma de los objetos interpuestos en su camino. Esto indica que son radiaciones que se propagan en línea recta.
Producción de sombra, por parte de los rayos catódicos
- Si se introduce un molinete de metal dentro del tubo que produce rayos catódicos, dicho molinete comienza a girar. Esto demuestra que están constituidos por partículas materiales.
- Si se los somete a la acción de un campo eléctrico, se desvían hacia el polo positivo. Un efecto equivalente se observa con un campo magnético. Por lo tanto, se deduce que los rayos catódicos tienen carga negativa.
Acción de la electricidad sobre los rayos catódicos
En resumen:
«Los rayos catódicos son radiaciones que se propagan en línea recta, constituidas por partículas materiales que poseen carga eléctrica negativa».
A las partículas materiales negativas que constituyen los rayos catódicos. J. Stoney le dio el nombre de electrones.
Diversas experiencias demostraron que la masa y la carga eléctrica de los electrones son idénticas, cualquiera sea el gas que llene el tubo de descarga y el material de que esté hecho el cátodo.
Por eso, se dedujo que los electrones son constituyentes de toda clase de materia.
J.J. Thomson (1897) y R. A. Millikan (1909) determinaron la masa y la carga eléctrica de estos corpúsculos, estableciendo que el electrón tiene una masa igual a 9,1·10-28 gramos (0,00055 u.m.a.) y una carga eléctrica de 1,6·10-19 coulomb.
Coulomb (C): Unidad SI de carga eléctrica equivalente a la carga de dos cuerpos que están a 1 m de distancia y se atraen o repelen con la fuerza de 1 N.
La carga eléctrica del electrón es la más pequeña que se conoce, por eso también se la denomina unidad elemental de carga eléctrica negativa (u.e.c) y se le asigna un valor de -1.
Rayos canales. Los protones
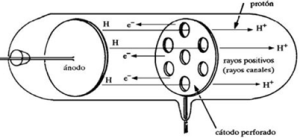
En 1886, Goldstein realizo por primera vez un experimento utilizando un tubo de descarga que contenía hidrógeno y con el cátodo perforado.
Al conectarlo a una fuente de alta tensión, observó por detrás del cátodo un fino haz de luz, formado por rayos que pasaban a través de la perforación, que por ese motivo, fueron denominados rayos canales.
El análisis de dichos rayos permitió deducir que estaban constituidos por partículas con carga eléctrica positiva, a las que llamó protones.
Por medio de técnicas adecuadas se estudiaron su masa y su carga eléctrica, comprobándose que la masa de los protones es 1.840 veces mayor que la de los electrones y la carga eléctrica es igual a la de los electrones, pero de signo contrario.
Experimento de Goldstein
Entonces se ha establecido que:
El protón tiene una masa de 1,67·10-24 gramos (1,00732 u.m.a.) y una carga eléctrica de 1,6·10-19 coulomb.
Para mayor sencillez la carga del protón se expresa como unidad elemental de carga eléctrica positiva (u.e.c.), asignándole un valor de +1.
El hecho de haberse comprobado que en los átomos hay dos clases de partículas materiales, electrones, con una carga negativa y protones, con carga positiva, confirma la divisibilidad de los átomos y la naturaleza eléctrica de la materia.
Modelo atómico de Thomson
Joseph John Thomson fue un científico británico que vivió entre los años 1856 y 1940, en 1898 expuso lo que se considera el primer modelo atómico. Descubrió el electrón y los isótopos. Ganó el Premio Nobel de Física en 1906.

Este descubrimiento logro desechar el primer postulado de Dalton ya que desde ese momento se considera el átono divisible. Thomson también logro demostrar la reacción entre la masa y la carga del electrón
En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones. El modelo era estático porque en él no había ninguna partícula en movimiento.
Hechos en los que se basó:
– La investigación del proceso de electrólisis (proceso que separa los elementos de un compuesto por medio de la electricidad) posibilitó inferir que la materia es de naturaleza eléctrica.
– Los experimentos sobre descargas eléctricas en gases a baja presión permitieron comprobar que los átomos están formados por partículas materiales negativas (electrones) y positivas (protones). A partir de estos descubrimientos Thomson propuso el primer modelo atómico.
– Experimento de Rutherford (1911): Ernest Rutherford, bombardeo de una lámina de oro con partículas α (+), en el que la mayoría de éstas atravesaban la lámina, algunas sufrían grandes desviaciones y unas pocas rebotaban». Rutherford lo interpreto concluyendo que el átomo es hueco, con gran espacio vacío. Este experimento puso en crisis el modelo atómico de Thomson.
El átomo tiene núcleo positivo
La radiactividad
A fines del siglo XIX (1896) Henri Becquerel, estudiando el fenómeno de fluorescencia en diferentes sustancias hizo, en forma imprevista, un notable descubrimiento: la radiactividad.
Trabajando con compuestos de uranio, observó que tenían la propiedad de emitir radiaciones en forma espontánea y sin necesidad de ser excitados por la luz.
Este descubrimiento atrajo la atención de muchos investigadores, entre ellos los esposos Marie y Pierre Curie, quienes luego de pacientes investigaciones lograron aislar otros dos elementos radiactivos: el polonio y el radio.
Más adelante se fueron descubriendo nuevas sustancias radiactivas hasta llegar a la actualidad en que se conocen aproximadamente cuarenta.
Como resultado de los diferentes experimentos realizados, se puede establecer que:
«La radiactividad natural es la propiedad que presentan ciertos elementos químicos de emitir radiaciones espontáneamente».
Tipos de radiaciones
Los científicos E. Rutherford, (1899) y Villard (1900) pudieron identificar, dentro de las radiaciones emitidas por la sustancias radiactivas, tres tipos diferentes.
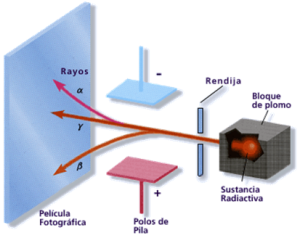
Para verificar esta hecho, se coloca una cantidad escasa de sustancia radiactiva en una cavidad practicada en un bloque de plomo, con un pequeño orificio de salida.
Las radiaciones que salen por dicho orificio son sometidas a la acción de campos eléctricos positivos y negativos.
Acción de un campo eléctrico sobre las radiaciones
Se observa que algunas radiaciones se desvían hacia la placa negativa, otras hacia la positiva y unas terceras no sufren desviación, siendo denominadas radiaciones alfa (α), beta (β) y gamma (γ), respectivamente.
Los rayos alfa están constituidos por partículas positivas que se mueven a una velocidad entre 16.000 y 32.000 km/s y son poco penetrantes (atraviesan láminas delgadas de aluminio de menos de 0,002 mm de espesor). Además se comprobó que las partículas alfa tienen una masa de 4 u.m.a. y una carga eléctrica de 2+ u.e.c. como los núcleos de los átomos de helio.
Los rayos beta están formados por electrones con carga negativa que se desplazan a gran velocidad (160.000 km/s) y son más penetrantes que los rayos alfa (atraviesan láminas de aluminio de hasta 0,2 mm de espesor). Por ser electrones, su masa es mucho menor que la de las partículas alfa.
Los rayos gamma no son partículas sino radiaciones electromagnéticas de alta frecuencia que se mueven a muy alta velocidad (aproximadamente 300.000 km/s) y presentan gran poder de penetración (atraviesan láminas de aluminio de hasta un metro de espesor). Estos rayos son radiaciones con mayor energía que los rayos X y carecen de masa.
Las sustancias radiactivas no emiten simultáneamente las tres radiaciones: algunas emiten radiaciones alfa y otras beta, pero ambas generalmente acompañadas por rayos gamma.
La emisión de radiaciones por parte de un elemento radiactivo va acompañada comúnmente por su desaparición gradual y la aparición de otro elemento nuevo. Así, el uranio se desintegra originando átomos de torio y partículas alfa. Este proceso se denomina transmutación, y permite inferir que los átomos son sistemas complejos que en ciertos casos se pueden fragmentar.
Efectos biológicos de las radiaciones
Las radiaciones afectan a los seres vivos cundo tienen una longitud de onda inferior 10 Å. La reacción de las células a la radiactividad depende de la intensidad y tiempo de exposición a las radiaciones y de la sensibilidad de los tejidos irradiados.
Las células son tanto más sensibles a las radiaciones cuanto mayor sea su capacidad de reproducción y menos definidas estén su morfología y función. (Bergonnier y Trimbondeau).
La radiactividad puede ocasionar en los seres humanos trastornos genéticos, anemia, leucemia, acortamiento de la vida, predisposición al cáncer, hemorragias, etcétera y llegar hasta la muerte inmediata del individuo si ha sido afectado por una irradiación aguda, como en el caso de la bomba atómica o el conocido accidente de la usina atómica de Chernóbil (URSS).
Sin embargo, utilizada en condiciones y dosis adecuadas, tiene muchas aplicaciones benéficas en medicina, tales como tratamiento anticancerosos, diagnóstico de enfermedades, esterilización de instrumental, etcétera.
Experiencia de Rutherford
El descubrimiento de la radiactividad permitió seguir avanzando en la interpretación de la estructura del átomo.
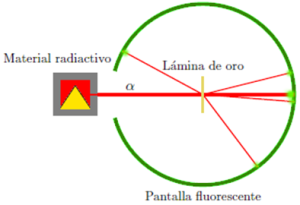
Así, en 1911, Ernest Rutherford (1871-1937) con la finalidad de comprobar la veracidad del modelo de Thomson, investigó la dispersión que experimentaban las partículas alfa al atravesar una lámina muy delgada de oro.
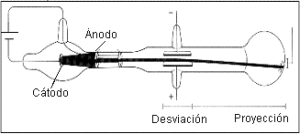
Para realizar esta experiencia, Rutherford hizo incidir un haz de partículas alfa (positivas) provenientes de una sustancia radiactiva, contenida en un bloque de plomo, sobre una hoja de oro de muy pequeño espesor (10-4 mm).
Detrás de la lámina de oro coloco una pantalla recubierta de sulfuro de cinc (fluorescente) que permite detectar el choque de cada partícula en los diferentes puntos de dicha pantalla:
Los resultados obtenidos en esta experiencia y su interpretación fueron los siguientes:
- La mayoría de las partículas alfa atraviesan la lámina sin sufrir desviación alguna. Esto permitió deducir que los átomos tienen grandes espacios vacíos, por lo cual las partículas alfa no encuentran ningún obstáculo en su camino.
- Algunas partículas alfa (aproximadamente una por cada 10.000) sufrieron pequeñas desviaciones, de menos de 90º. Estas desviaciones hicieron suponer que en el átomo hay una pequeña zona con carga eléctrica positiva que repele a las partículas alfa también positivas (cargas de igual signo se repelen).
- Muy escasas partículas alfa (una por cada 125.000) rebotaron sobre la lámina de oro y retrocedieron en su trayectoria. Este hecho llevó a Rutherford a sugerir que la masa del átomo está concentrada en el centro del átomo, donde rebotan esas partículas. Así surgió la idea de que el átomo cuenta con un núcleo central, donde están agrupadas las cargas positivas y la mayor parte de la masa.
Esta experiencia de Rutherford hizo descartar el modelo de Thomson y permitió deducir cómo están distribuidas las cargas eléctricas y la masa en el átomo, constituyendo un importante avance en el conocimiento de la estructura atómica.

Arriba: Resultados esperados: Las partículas alfa pasando a través del modelo del pudding con pasas sin verse alteradas.
Abajo: Resultados observados: Una pequeña parte de las partículas eran desviadas, demostrando la existencia de un minúsculo volumen de carga positiva
Modelo atómico de Rutherford
Ernest Rutherford fue un químico y físico neozelandés que vivió entre los años 1871 y 1937 que dedicó gran parte de su vida a estudiar las partículas radioactivas (partículas alfa, beta y gamma). Ganó el Premio Nobel De La Química en 1908.
Rutherford, basándose en los resultados obtenidos en sus experimentos de bombardeo de láminas delgadas de metales, estableció el llamado modelo atómico de Rutherford o modelo atómico nuclear, según el cual:
*El átomo está formado por un núcleo central, con carga eléctrica positiva, rodeado por los electrones negativos.
*El núcleo es muy pequeño con relación al diámetro total del átomo, pero contienen la mayor parte de la masa atómica. Esto indica que el átomo tiene grandes espacios vacíos, sin partículas materiales.
*Los electrones giran alrededor del núcleo sin chocar con él, a distancias variables, pero sin exceder un cierto diámetro.
*El número de electrones es el suficiente para compensar la carga positiva del núcleo, de manera que el átomo, en conjunto, resulta neutro.
*Los electrones tienen una masa despreciable con relación a la masa total del átomo.
Este modelo se suele comparar con el sistema solar, de modo que el núcleo representa al Sol y los electrones a los planetas.
Limitaciones:
Rutherford, sobre la base de los cálculos matemáticos, pudo establecer que el núcleo del átomo tiene un diámetro promedio de 10-13cm (10-5 Å), mientras que el diámetro total del átomo tiene en promedio un valor de 10-8 cm (1Å).
Esto significa que el diámetro del núcleo es 10.000 veces menor que el diámetro total del átomo.
Para tratar de comprender la pequeñez del núcleo con respecto a todo el átomo, puede pensarse que si el núcleo fuese una esfera de 1 cm de diámetro, el átomo sería una esfera con un diámetro igual a 100 metros (aproximadamente la longitud de una cuadra).
Si el átomo fuese una esfera cuyo diámetro midiera el largo de una cancha de fútbol, el núcleo sería un botón de 1 cm de diámetro ubicada en el centro.
La espectroscopia
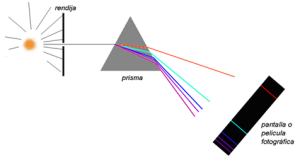
La luz solar es una forma de energía que se propaga por ondas electromagnéticas cuya velocidad en el vacío es de 300.000 km/s. esta luz blanca está formada por siete colores que se dispersan cuando atraviesan un prisma.
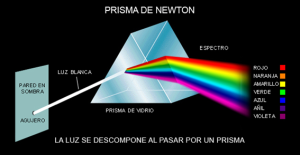
Ese mismo fenómeno es el que se observa cuando la luz solar atraviesa las gotas de lluvia, que actúan como pequeños prismas, formando el arco iris.
La secuencia de bandas de colores que va desde el rojo hasta el violeta se denomina espectro, palabra que etimológicamente significa “fantasma”. El espectro formado por la luz blanca es continuo porque se va pasando gradualmente de un color a otro.
Los diferentes colores del espectro solar dependen de la longitud de onda de las radiaciones y corresponden a distintas cantidades de energía luminosa.
Al atravesar el prisma, se desvía más el violeta por ser el de menor longitud de onda (mayor contenido energético) y sufre menos desviación el rojo por ser el de mayor longitud de onda (menos energía).
Los espectros atómicos
También se ha observado que las sustancias al ser calentadas producen radiaciones luminosas de colores característicos. Así, si se expone a la llama un alambre de cobre, se observa que la llama tomo un color verde; los compuestos de sodio dan una radiación de color amarillo; los compuestos de potasio, violeta, y los compuestos de calcio, anaranjado.
Cuando se hace pasar a través de un prisma óptico la luz emitida por un cuerpo caliente, se produce la dispersión de las distintas radiaciones electromagnéticas que la componen debido a que tienen diferentes longitudes de onda.
Hacia mediados del siglo XIX, Bunsen y Kirchoff, investigaron los espectros producidos por la radiación que emiten las sustancias cuando son excitadas por el calor. Para realizar sus estudios utilizaron el espectroscopio, que puede esquematizarse así:
Este espectro es discontinuo pues no hay una transición gradual de una línea a otra. A modo de ejemplo, vemos los siguientes espectros de emisión:
Espectro de emisión del hidrógeno (H)
Espectro de emisión del mercurio (Hg)
Cada elemento químico origina un espectro de rayas que le es característico y distinto de los otros elementos.
Cada una de las líneas corresponde a una clase de radiación luminosa con un determinado contenido energético.
La formación del espectro de rayas indica que los átomos emiten energía en valores definidos y concretos y no en cantidades variables.
Interpretación de Bohr
En 1913, Niels Bohr propuso una hipótesis que explica a qué se deben los espectros de rayas y cómo están distribuidos los electrones en el átomo. Para ello tomó como base la teoría cuántica de Planck, la cual sostiene que la energía es discontinua, porque está formada por ciertas porciones llamadas cuantos, de modo similar a lo que sucede con la materia, formada por átomos.
Entonces, la energía que radian los átomos cuando son sometidos a la acción del calor no puede tener cualquier valor sino que debe ser múltiplo de dichos cuantos, se emiten 1, 2, 3 o más cuantos y no valores intermedios, tales como 1,2 o 2,8.
Planck determinó que el valor del cuanto no es siempre el mismo sino que depende de la frecuencia de la radiación emitida, estableciendo que dicho valor es igual a:
E= h ∙ v
E: energía
h= constante de Planck= 6,624∙10-34 j
v= frecuencia de radiación
Bohr, aplicando lo postulado por Planck, sostuvo que los electrones no pueden encontrarse en el átomo con cualquier cantidad de energía, sino con valores concretos y definidos, es decir, en determinados niveles de energía.
Cuando el átomo recibe energía, como por ejemplo calor, los electrones pasan aniveles superiores. Luego, cuando se va enfriando, emite la energía ganada en forma de radiaciones luminosas y los electrones vuelven a los niveles en que se encantaraban al comienzo.
Cuando un electrón salta a un nivel superior absorbe un cuanto de energía que recibe del exterior (calor, luz, electricidad).
Cuando un electrón salta de un nivel a otro inferior pierde un cuanto de energía, emitiendo una radiación luminosa característica
Esta es la causa de la formación de rayas en los espectros producidos por las sustancias incandescentes. Cada una de las rayas coloreadas indica la diferencia entre dos niveles de energía de los electrones del átomo.
En base a esta interpretación, Bohr sostuvo que los electrones giran alrededor del núcleo en órbitas o niveles de energía definidos.
El modelo atómico de Bohr
En 1913, el físico danés Niels Bohr, basándose en la teoría cuántica de Planck y en el análisis del espectro de emisión del hidrógeno, propuso un nuevo modelo atómico.
En él, mantenía la estructura planetaria propuesta por Rutherford, pero hacía las siguientes precisiones acerca de la disposición de los electrones alrededor del núcleo:
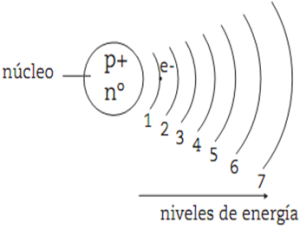
*Los electrones no poseen cualquier cantidad de energía sino valores determinados (cierto número de cuantos).*Los electrones sólo pueden girar alrededor del núcleo positivo en determinas órbitas circulares, denominadas niveles de energía. En estas órbitas, los electrones se mueven sin perder energía.*Cuando el electrón gira en la órbita más próxima al núcleo se encuentra en su estado más estable (estado fundamental)*Cuando un electrón salta de un nivel a otro inferior pierde un cuanto de energía, emitiendo una radiación luminosa característica.*Los niveles de energía se identifican con números naturales, denominados números cuánticos principales (n). El nivel de menor energía (más próximo al núcleo) se le asigna el número 1, continuando con el 2 para el siguiente y así sucesivamente hasta llegar al 7. La expresión niveles de energía es sinónimo de orbita o de capa, que son las denominaciones utilizadas en los primeros modelos atómicos. Las orbitas o capas también se identifican con las letras K, L, M, N, O, P, Q.
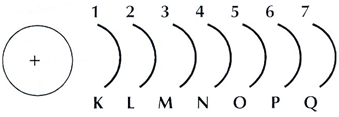
*El número de electrones para cada nivel energético no puede ser superior a 2∙n2. Así, para el nivel (n=1) resulta 2∙12= 2; para el segundo nivel (n=2), 2∙22= 8; para el tercero (n=3), 2∙32= 18; etcétera.
*La diferencia de energía entre los niveles va siendo cada vez menor a medida que se alejan del núcleo. Por lo tanto, los niveles están más próximos entre sí a medida que aumenta el valor de n.
Limitaciones del modelo de Bohr
1.- El modelo de Bohr explicaba muy bien los espectros de los átomos con un solo electrón en la capa más externa. Sin embargo, aparecieron serias diferencias entre el modelo y el experimento en los espectros de los átomos con dos o más electrones en la capa más externa.
2.- Los experimentos también pusieron de manifiesto que cuando una muestra de un elemento se coloca en un campo eléctrico o magnético su espectro de emisión muestra líneas adicionales. Por ejemplo, en un campo magnético cada línea se divide en varias líneas. El modelo de Bohr no pudo explicar, de manera cuantitativa, algunas de las divisiones observadas.
3.- Además, el modelo no proporcionaba explicación alguna para el brillo relativo (intensidad) de las líneas espectrales. Estas intensidades relativas dependen de las probabilidades con las que los átomos en una muestra experimentan transiciones entre los estados estacionarios; altas probabilidades se traducen en líneas más intensas. Se debería poder calcular la probabilidad de una transición de un estado estacionario a otro, pero el modelo de Bohr no permitía hacerlo.
Descubrimiento del neutrón
En 1920, Rutherford supuso que en el núcleo atómico, además de protones, existía una partícula sin carga eléctrica que por esta causa era difícil de descubrir.Esto fue confirmado por James Chadwidk, en 1932, al comprobar la existencia de una partícula nuclear eléctricamente neutra y con una masa aproximadamente igual a la del protón, que fue denominada neutrón.Experimentalmente se ha establecido que:
El neutrón tiene una masa de 1,6748∙10-24 gramos (1,00866 u.m.a.) y no manifiesta carga eléctrica.
Modelo Rutherford-Bohr
Sobre la base de las investigaciones de Rutherford y Bohr, la estructura del átomo se puede resumir del siguiente modo:-El átomo está compuesto por protones, neutrones y electrones
-El átomo consta de un núcleo formado por protones y neutrones. Estas partículas son las responsables de la masa del átomo.
-El núcleo tiene carga eléctrica positiva porque los protones son positivos y los neutrones carecen de carga.
-En la zona extra nuclear, también llamada corteza, se encuentran los electrones cuya masa es casi despreciable. Esta zona presenta grandes espacios vacíos.
-Los electrones giran a altas velocidades, describiendo órbitas circulares a diferentes distancias del núcleo en determinados niveles de energía. Cada uno de estos niveles solo admite un cierto número de electrones (el número máximo de electrones de cada nivel se calcula aplicando la formula 2∙n2).
-La cantidad de protones positivos es igual a la cantidad de electrones negativos, de modo que el átomo en su conjunto es eléctricamente neutro.
LA CORRECCIÓN DE SOMMERFIELD
La hipótesis de Bohr explicaba bien los espectros del átomo de hidrógeno, que es el más sencillo, pero no ocurría lo mismo con los átomos de otros elementos que son más complejos.
Esto obligó a continuar y profundizar las investigaciones. El físico alemán Arnold Sommerfeld (1868-1951) sugirió que los electrones, además de órbitas circulares, describen órbitas elípticas que se multiplican hasta destinar una para cada electrón.
Kessel, Lewis y Langmuir suponen que tales elipses no se encuentran en un solo plano, sino en diferentes planos del espacio. Además, el núcleo puede estar en el centro (órbitas centradas) o desplazado hacia un polo (órbitas excéntricas).
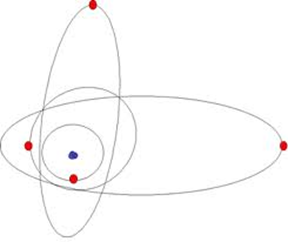
Los subniveles energéticos
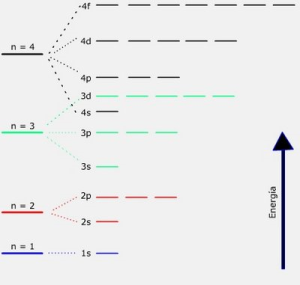
Bohr suponía que todos los electrones de una misma órbita o nivel tienen igual cantidad de energía. Sin embargo, el estudio de los espectros de diferentes elementos demostró que, a excepción del primer nivel de energía, los otros están formados por varios subniveles íntimamente agrupados entre sí.
Se ha establecido que el número de subniveles de cada nivel energético es igual al número cuántico principal (n) de ese nivel. Así, la órbita K (n=1) consta de un solo nivel; la órbita L (n= 2) de dos subniveles; la órbita M (n= 3) de tres subniveles y así sucesivamente.
Entonces los dos electrones de la órbita K poseen misma energía, pero en las otras órbitas o niveles no todos los electrones tienen exactamente la misma cantidad de energía. En la órbita L (n= 2) los ocho electrones que pueden existir se encuentran separados en dos grupos con diferente contenido energético; en la órbita M (n=3) hay tres grupos; en la órbita N (n=4) hay 4 grupos; etcétera.
Los subniveles se designan con las letras s, p, d, y f, que corresponden a las iniciales de las palabras del inglés relacionadas con los espectros atómicos: Sharp, permanent, diffuse y fundamental.
|
Sharp= agudo Permanent= permanente Diffuse= difuso Fundamental= fundamental |
El nivel energético 1 (k) presenta el subnivel s; el nivel 2 (L), los subniveles 2s y 2p; el nivel 3 (M), los subniveles 3s, 3p, y 3d; el nivel 4 (N), los subniveles 4s, 4p, 4d y 4f, etcétera.
Así como cada nivel admite un máximo de electrones, cada subnivel tiene limitado el número de electrones que puede contener: los subniveles s hasta dos electrones, los subniveles p hasta seis, los subniveles d hasta diez y los f hasta catorce.
Lo antes expuesto puede esquematizarse del siguiente modo:
Diagrama de niveles y subniveles energéticos
En el análisis de este diagrama llama la atención el entrecruzamiento de los subniveles 4s y 3d. Como ya fue expresado, la diferencia de energía entre los niveles es cada vez menor a medida que se alejan del núcleo, es decir, que el nivel 1 está más separado del 2 que este del 3 y así sucesivamente.
Entonces, a medida que aumenta el valor de n, los niveles de energía están más próximos entre sí. Además, al aumentar n también crece el número de subniveles de cada nivel.
Esto determina que en los niveles superiores las energías de los subniveles cercanos difieran muy poco entre sí, llegando a su entrecruzamiento.
Éste es aún mayor si se consideran los niveles 5, 6 y 7.
EL MODELO MECÁNICO-CUÁNTICO
Se inicia con los estudios del físico francés Luis De Broglie, quien recibió el Premio Nobel de Física en 1929. Según De Broglie, una partícula con cierta cantidad de movimiento se comporta como una onda.
En tal sentido, el electrón tiene un comportamiento dual de onda y de corpúsculo, pues tiene masa y se mueve a velocidades elevadas.
Al comportase el electrón como una onda, es difícil conocer en forma simultánea su posición exacta y su velocidad, por lo tanto, solo existe la posibilidad de encontrar el electrón en un cierto momento y en una región dada en el átomo, denominándose a tales regiones orbitales.
La idea principal de este postulado se conoce con el nombre de Principio de incertidumbre de Heisenberg.
La mecánica cuántica moderna se basa en la teoría de Planck y tomó como punto de partida la dualidad onda-corpúsculo de Luis De Broglie y el principio de incertidumbre de Heisenberg. Esta teoría es capaz de explicar en forma satisfactoria la constitución atómica y otros fenómenos fisicoquímicos.
Dualidad onda-partícula
Albert Einstein, en 1905, cuando trataba de explicar el efecto fotoeléctrico, sostuvo que la luz no se comporta solo como onda, sino que lo hace también como un chorro de corpúsculos a los que denominó fotones.
En 1923, el físico francés Luis de Broglie (1892-1927) propuso que el fotón puede ser considerado como un corpúsculo que parte del cuerpo luminoso y que en su rápido movimiento origina una onda electromagnética, del mismo modo que un proyectil que se desplaza a alta velocidad origina en el espacio circundante ondas que nosotros percibimos como sonidos.
Por otra parte, si la luz presenta un comportamiento dual (partícula-onda), ¿por qué no pensar que todas las partículas pequeñas también pueden presentarlo?
Este cuestionamiento, hizo que De Broglie sostuviera que las partículas muy pequeñas que se desplazan a alta velocidad (como es el caso de los electrones) tienen la propiedad de comportarse, en ocasiones como corpúsculos materiales y, en otros fenómenos, como ondas.
Así, un haz de electrones, en ciertos casos, actúa como partícula, rebotando sobre la superficie solida de un cuerpo y, en otros, como onda, difractándose al atravesar un cristal sólido de modo similar a lo que le sucede a un haz de luz que pasa por una rendija estrecha.
Este razonamiento llevo a De Broglie enunciara el siguiente principio:
«Toda partícula en movimiento está asociada a una onda».
Entonces, las pequeñas partículas en movimiento pueden comportase como ondas o como corpúsculos. El carácter ondulatorio se manifiesta especialmente en ciertos fenómenos, mientras que el corpuscular prevalece en otros.
Este comportamiento dual que presentan las partículas en movimiento se suele denominar dualidad onda-partícula.
Principio de incertidumbre y probabilidad
Cuando se ilumina un cuerpo en movimiento, como sucede al tomarle una fotografía, se hace incidir sobre dicho cuerpo una radiación dotada de energía. Si el objeto es de un tamaño considerable, la radiación no modifica su velocidad ni su posición. Pero si se trata de una partícula muy pequeña, cuya energía es equivalente a la de los fotones de la luz, la velocidad de esa partícula será modificada en el momento en que se produce el choque.
Esta observación llevo al físico alemán Werner Heisenberg, en 1926, a enunciar el principio de incertidumbre:
«Es imposible conocer con certeza en forma simultánea la velocidad y la posición de una partícula en movimiento».
En el caso del electrón, si se intenta determinar su posición en un momento dado fotografiándolo, la luz modifica su velocidad; por el contrario, si se desea conocer su velocidad en un determinado instante, la posición se verá borrosa.
Entonces, como resulta imposible determinar la trayectoria del electrón dentro del átomo, es mejor buscar la probabilidad de que dicho electrón se encuentre en una determinada zona del átomo.
El cálculo para determinar la probabilidad de establecer la posición del electrón en un átomo es un problema matemático muy complejo que se resuelve aplicando los principios de la mecánica ondulatoria.
Ésta utiliza la ecuación matemática sobre el movimiento de las ondas para deducir la probabilidad de localizar las partículas minúsculas, como los electrones, que se pueden comportar como ondas.
Así, resolviendo la ecuación de ondas de Schródinger, se puede conocer la probabilidad de encontrar un electrón a diferentes distancias del núcleo.
Orbital atómico
En el caso del hidrógeno, que es el átomo más simple que existe, aplicando la ecuación de onda de Schródinger se obtiene el siguiente gráfico:
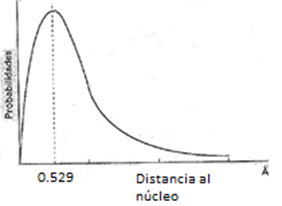
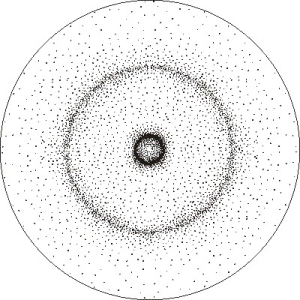
En este gráfico se observa que la probabilidad de encontrar el electrón en el núcleo es cero.
A medida que se aleja del núcleo aumenta dicha probabilidad hasta alcanzar su máximo valor a la distancia de 0,529 Å. A partir de allí la probabilidad disminuye paulatinamente.
La distancia 0,529 Å coincide con el radio que había deducido Bohr para el primer nivel de energía.
Esto permite comprender por qué el modelo de Bohr explicaba bien el espectro del hidrógeno aunque no sucedía lo mismo con los otros elementos. Además, demuestra que dicho modelo de Bohr es una aproximación al modelo atómico moderno.
La interpretación del gráfico permite deducir que la probabilidad de encontrar el electrón está dada en una zona esférica de un radio de 0,529 Å alrededor del núcleo, que puede representarse tal cual aparece en la figura adjunta:
Esta esfera es de contornos difusos porque existe alguna probabilidad, aunque muy pequeña, de que el electrón este fuera de la zona de mayor densidad.
En consecuencia, se puede imaginar al núcleo positivo del átomo rodeado por una nube de carga negativa, producida por el electrón en movimiento. Dicha nube es más densa en la región en que existe mayor probabilidad de encontrar al electrón.
Es conveniente aclarar que en la actualidad se habla del electrón no tanto como partícula sino como una onda o nube de carga negativa que ocupa un espacio alrededor del núcleo.
A partir de esta interpretación se estableció el concepto de orbital atómico, que puede expresarse así:
«Orbital atómico es la zona alrededor del núcleo donde existe la mayor probabilidad de encontrar al electrón».
La noción de orbital difiere sustancialmente de la idea de órbitas definidas que los electrones describen en su movimiento giratorio alrededor de núcleo, según sostenía Bohr.
Recapitulando:
La teoría moderna supone que el núcleo del átomo está rodeado por una nube tenue de electrones que retiene el concepto de niveles estacionarios de energía, pero a diferencia del modelo de Bohr, no le atribuye al electrón trayectorias definidas, sino que describe su Idealización en términos de probabilidad.
Esta teoría deriva de tres conceptos fundamentales:
1. Concepto de estados estacionarios de energía del electrón propuesto por Bohr.
Normalmente los electrones se encuentran en el nivel de mínima energía (estado basal o fundamental), pero pueden absorber energía, pasando a un nivel superior, más alejado del núcleo (estado excitado); este estado es inestable y al regresar el electrón a su nivel original emite la energía absorbida en forma de radiación electromagnética.
Mientras los electrones describen una órbita, no hay absorción ni emisión de energía.
2.Naturaleza dual de la masa sugerida por Luis De Broglie.
Las partículas muy pequeñas que se desplazan a alta velocidad (como es el caso de los electrones) tienen la propiedad de comportarse, en ocasiones como corpúsculos materiales y, en otros fenómenos, como ondas (dualidad onda-partícula).
3. Principio de incertidumbre de Heisenberg.
Werner Heisenberg presentó el principio de incertidumbre como una consecuencia de la dualidad de la naturaleza del electrón.
Heisenberg imaginó un microscopio súper potente por medio del cual se pudiese observar la colisión entre un fotón y un electrón, y postuló que, debido a que ambos cambian su posición y su velocidad, es imposible en un momento dado establecer la posición y velocidad del electrón en un nivel energético.
Fue así como Schrödinger, después de sopesar las ideas de Bohr y de De Broglie, y tratando de aunar ambas, dedujo una ecuación matemática en la que el electrón era tratado en función de su comportamiento ondulatorio.
De acuerdo con la ecuación de onda de Schrödinger, la posición probable de un electrón está determinada por cuatro parámetros llamados cuánticos, los cuales tienen valores dependientes entre sí.
¿Cuál es la forma y el número de orbitales de cada nivel?
El concepto de orbital es abstracto, es una función de ondas de la cual deriva una ecuación de probabilidades.
Sin embargo, es útil lograr una representación física que sea lo más fiel posible al modelo matemático.
La forma de los orbitales depende del subnivel que ocupa el electrón.
Los orbitales de los subniveles s tienen forma esférica. Esto implica que la probabilidad de encontrar al electrón es igual en todas las direcciones a partir del núcleo y solo depende de la distancia al mismo. En cada subnivel s hay un solo orbital s.
El núcleo del átomo está en el centro de la esfera, en la intersección de los ejes x, y, z
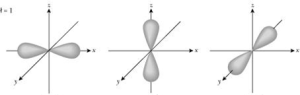
Los orbitales de los subniveles p no presentan simetría esférica. La probabilidad de encontrar al electrón no solo depende de la distancia al núcleo, sino también de la dirección que se sigue.
De acuerdo con el cálculo de probabilidades, se considera que un orbital p está formado por dos esferas difusas a ambos lados del núcleo.
En cada subnivel p hay tres orbitales p que suelen llamarse px, py y pz, los cuales son perpendiculares entre si y se hallan orientados hacia los tres ejes x, y, z de un sistema cuyo origen está en el núcleo.
Los subniveles d constan de cinco orbitales y los subniveles f de siete. Sus formas aumentan en complejidad.
Fuente:
WikiAlmeraya. (s.f.) Modelos atómicos. Recuperado de http://www.juntadeandalucia.es/averroes/~04001205/pmwiki/pmwiki.php?n=Fyq.ModelosAt%F3micos
CIDEAD. (s.f.). El átomo y los modelos atómicos. Recuprado de http://recursostic.educacion.es/secundaria/edad/3esofisicaquimica/impresos/quincena5.pdf
Aula Taller. José María Mautino. Editorial Stella.
Wikipedia.